Plateforme Activité et Criblage Enzymatique (PACE)
Cette plateforme fait partie du service UCA-PARTNER (Plateformes Assistance à la Recherche, aux Technologies et aux Entreprises) de l’Université Clermont Auvergne.
Pour toute demande de prestations et d’informations, vous pouvez contacter :
Franck Charmantray, Responsable du Service / Franck. Charmantray@uca.fr Tél. : 04.73.40.76.42
Savoir-Faire :
Cette plateforme permet de gérer de façon automatisée le remplissage de microplaques 96 puits dans le cadre de dosages analytiques de composés et/ou le suivi d’activité enzymatique en parallèle. Sont susceptibles d’être dosés les composés présentant un chromophore, un fluorophore ou un luminophore.
Domaines d’applications :
- Chimie analytique (analyse quantitative)
- Biochimie (enzymologie)
Secteurs d’activités :
Recherche – recherche et développement en biocatalyse, enzymologie et chimie analytique pour les secteurs de la chimie et biologie -santé
Équipements :
- Plateforme de travail EVO® Tecan (bras robotisé, 4 aiguilles (capacité 5 à 950 µL), agitateur de microplaques, cryostat)
- Lecteur de microplaques 96 ou 384 puits Safire II® Tecan
- Centrifugeuse à microplaques Heraeus® Labofuge® 400 R (Thermoscientific)
Prestations :
- Gestion d’une chimiothèque : Conditionner, dupliquer, mixer des microplaques en vue de l’exploitation d’une chimiothèque.
- Préparation d’échantillons avant analyse : Purification d’échantillons par dilution, centrifugation, agitation, aliquotage, filtration sur phase solide.
- Tests chimiques ou enzymatiques : Adaptation d’un protocole établi (ex : kit de dosage enzymatique) au format d’une microplaque 96 puit et lecture en absorbance, fluoresecnce, luminescence.
Développement méthodologique :
- Recherche et développement de nouveaux tests susceptibles de répondre à une problématique de dosage chimique et/ou enzymatique en partenariat avec le responsable de la plateforme et ceci sous la forme d’une collaboration scientifique. (ex : mise au point d’un nouveau test de criblage fluorescent d’enzyme dans le cadre de le recherche de nouvelles activités).

Exemples d’applications
A – Biodégradation et de photodégradation du 2-aminobenzothiazole par des microorganismes
- Traitement d’échantillons automatisé :
But :
L’analyse des échantillons par HPLC nécessite un traitement préalable. Le protocole développé pour ôter l’alginate sur lequel les souches Rhodococcus Rhodochrous sont immobilisées, utilise une phase immobilisée SPE (solid phase extraction). Ce protocole doit être miniaturisé et automatisé.
Intérêts :
Gérer plusieurs dizaines d’échantillon en parallèle. Conditionner les échantillons recueillis en microvial.
Paramètres :
Détermination du Recovery (%) (Qté échantillon recueilli/Qté échantillon déposé). Vérifier l’absence de contamination croisée.
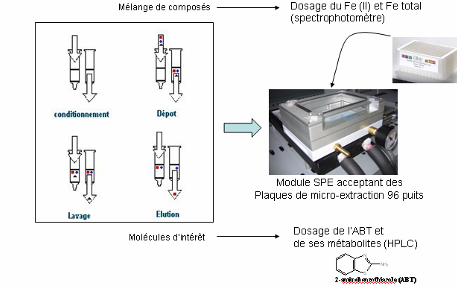
B – Test de criblage de transcétolase par fluorescence
But :
Déterminer la cinétique de la réaction catalysée par l’enzyme transcétolase (TK), grâce au suivi de la fluorescence de l’umbelliférone (molécule fluorescente, λabs = 365 nm, λémission = 452 nm) au cours du temps.
Intérêts :
La plateforme automatisée permet de réaliser plusieurs expériences en parallèle et à petite échelle en nous assurant d’une grande reproductibilité et d’un débit compatible avec le criblage ultérieur de banque(s) de mutants obtenus par évolution in vitro.
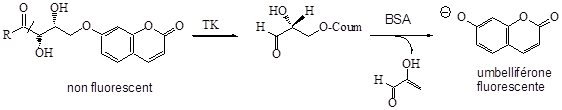
Principe du test fluorescent d’activité de TK
Résultats obtenus :
Paramètres statistiques
- Limites de détection (LOD) et limites de quantification (LOQ), selon les tampons choisis.
- Rapport Signal/Bruit et quantité minimale de TK détectable.
- Détermination du Z score (paramètre qui permet d’évaluer la pertinence d’un test de criblage avant son utilisation éventuelle en haut débit, HTS screening).
C – Dosage de l’ATP par la luciférase/luciférine
But :
Déterminer la concentration en ATP dans une gamme dynamique de 2x10-12 à 2x10-9 moles/litre grâce à la réaction entre la luciférine et l’ATP, catalysée en présence de luciférase et d’oxygène (voir schéma présenté ci-contre).
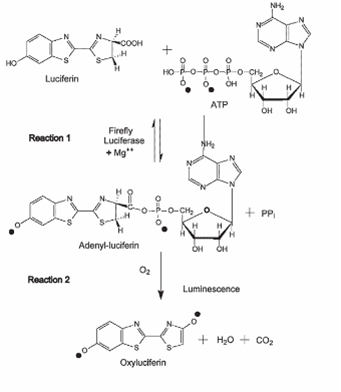
Dosage de l’ATP par le couple luciférase/luciférine
Intérêts :
- Le lecteur Safire® fonctionnant en mode luminescence peut se substituer à un luminomètre.
- Le coût de l’enzyme luciférase est élevé. En travaillant en microplaques jusqu’à des quantités inférieures à 100µL, il peut être minimisé.
Résultats :
- Gamme dynamique de mesure de l’ATP
- Protocole en macrocuve modifié pour l’utilisation en microplaques
