CESMA
Responsable : Pierre CHALARD, professeur SIGMA Clermont
Thèmes de recherche
L’objectif principal du CESMA est de développer de nouvelles molécules possédant une activité biologie pour des application thérapeutique (antalgique, anti-inflammatoire, cancer...) en s’appuyant sur les expertises de partenaires tels que NeuroDol (UMR 1107), UNH-ECREIN (UMR 1019), Institut Analgesia.
Afin d’atteindre nos objectifs, deux approches sont adoptées :
Approche « Extraction » : Des nombreuses plantes traditionnelles sont utilisées dans le traitement de la douleur et autres pathologies. Les efforts de recherche porteront ici sur l’identification de telles plantes et leur extraction afin d’en isoler les principes actifs. Ces molécules feront l’objet d’études pharmacologiques qui révéleront leurs modes d’action, et pourraient faire émerger de nouvelles cibles thérapeutiques.
Approche « Synthèse » : La cible thérapeutique a été identifiée par les pharmacologues et validée par des études spécifiques. Le CESMA s’efforcera de concevoir et synthétiser des molécules organiques visant ces cibles. L’objectif sera d’utiliser ces molécules organiques comme des outils afin de mieux comprendre les implications du ciblage ce qui validera le concept et prouvera que les cibles identifiées sont bien exploitables pour le développement de médicaments.
Membres permanents
Membres non permanents
- Asmini AHAMADA BACO (CDD)
- Robin AUGUSTE (Doctorant)
- Norberta DELPORTE (Doctorante)
- Maël GAINCHE (Post-doc)
- Laurie GONTHIER (CDD)
- Vanille JOSEPHINE (Stage M2)
- Marion LEROUX (Doctorante)
- Niroshan PADMANABAN (Stage M2)
- Dheenashri VIJAYAKUMAR (Stage M2)
Compétences
Les projets de recherche du CESMA se situent à l’interface de la chimie et la biologie et les compétences nécessaires reposent principalement sur la synthèse organique, l’extraction végétale, l’analyse chimique mais aussi la modélisation moléculaire, le drug design, en interactions avec des bio-scientifiques.
Projet TREK
Description du projet
Les antalgiques utilisés aujourd’hui sont anciens et présentent souvent des effets indésirables et/ou des efficacités parfois limités avec un ratio bénéfice/ risque faible. Face à ce constat et pour identifier une approche innovante et cliniquement plus pertinente, nous avons analysé le mécanisme d’action antalgique de la morphine (activation des canaux TREK1 via les récepteurs opioïdes µ) et avons démontré in vivo que l’activation directe de TREK1 conservait l’efficacité antalgique de la morphine en éliminant les effets indésirables. Un criblage de la Chimiothèque Nationale (CNE, ChemBioFrance) nous a permis d’identifier de nouvelles molécules activatrices de TREK1 possédant un effet antalgique in vivo. Nos travaux consistent à concevoir et synthétiser des analogues de ces leads puis de les soumettre à une évaluation biologique afin d’identifier des candidats-médicaments first-in-class avec une activité pharmacologique prometteuse.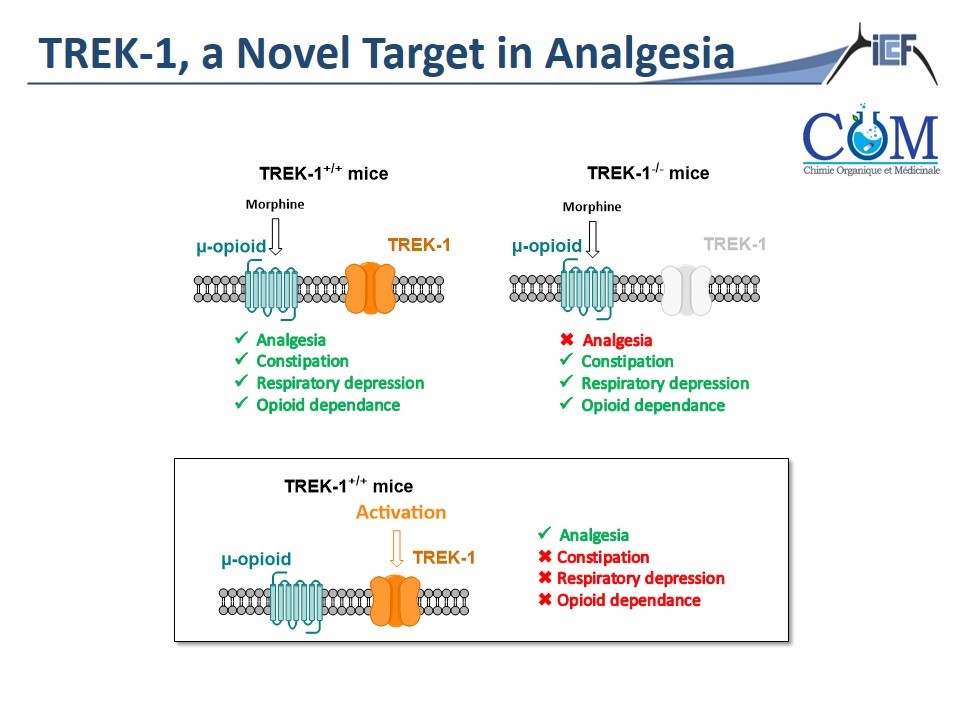
Publication associée
Busserolles, Jérôme; Ben Soussia, Ismail; Pouchol, Laetitia; Marie, Nicolas; Meleine, Mathieu; Devilliers, Maïly; Judon, Céline; Schopp, Julien; Clémenceau, Loïc; Poupon, Laura; Chapuy, Eric; Richard, Serge; Noble, Florence; Lesage , Florian; Ducki, Sylvie; Eschalier, Alain; Lolignier, Stéphane, “TREK-1 channel activation as a new analgesic strategy devoid of opioid adverse effects” British Journal of Pharmacology 2020, 177, 4782-4795.Financements
Conseil Régional AuRA / FEDER R&D Booster (2019-2022) “OPTIMDOL, Innovation dans le domaine de la douleur”
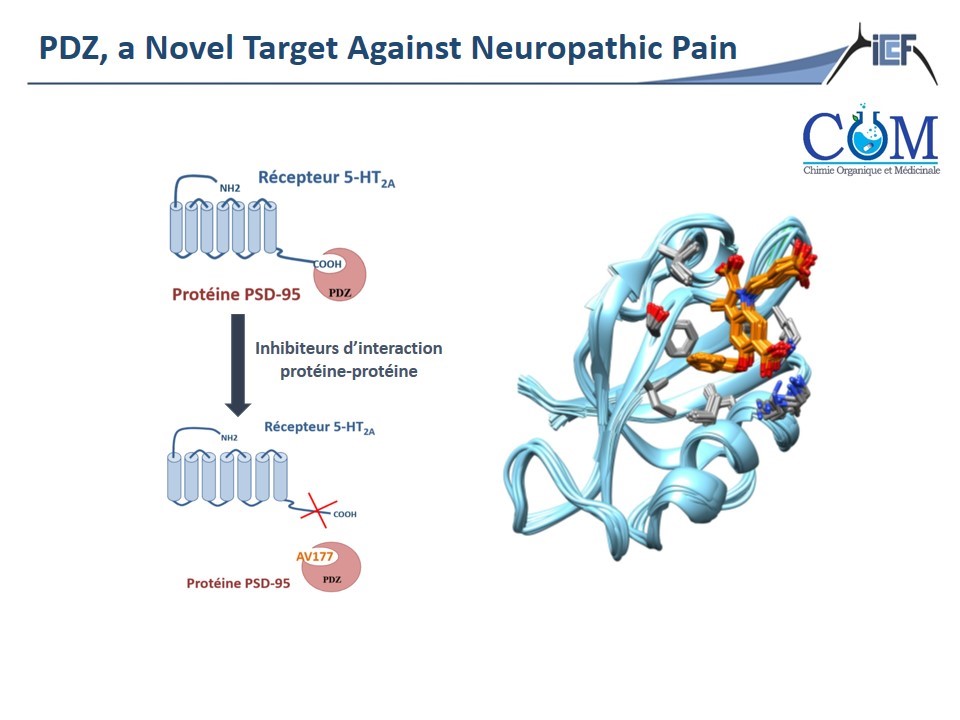
Projet PDZ
Description du projet
Actuellement, les douleurs neuropathiques sont très difficiles à soulager et leur prise en charge thérapeutique est largement insatisfaisante en raison de leur résistance aux antalgiques classiques (paracétamol, anti-inflammatoires non stéroïdiens, opioïdes) et du manque d’efficacité des traitements actuels de référence (antidépresseurs et antiépileptiques). Nos travaux montrent que des ligands interagissant avec les protéines à domaines PDZ (dont la protéine PSD-95), inhibant leur interaction avec les récepteurs sérotoninergiques 5-HT2A seraient une alternative prometteuse. En effet, nous avons démontré que l’interaction de la protéine PSD-95 avec le récepteur 5-HT2A est à l’origine de la résistance à la sérotonine des douleurs neuropathiques. Nos travaux ont mené au développement d’une molécule indolique (AV177) capable d’interrompre cette interaction et produisant un effet antalgique propre. L’inhibition de l’interaction entre le récepteur 5-HT2A et la protéine PSD-95 par la molécule AV177 constitue un concept novateur pour le traitement des douleurs neuropathiques. Nos travaux consistent à concevoir et synthétiser des analogues de ce lead puis de les soumettre à une évaluation biologique afin d’identifier des candidats-médicaments first-in-class avec une activité pharmacologique prometteuse.
Publications associées
Vogrig, A., L. Dorr, Bouzidi, N., Boucherle, B., Wattiez, A. S., Cassier, E., Vallon, G., Ripoche, I. Abrunhosa-Thomas, I., Marin, P., Nauton, L., Thery, V., Courteix, C., Lian, L. Y., Ducki, S. "Structure-Based Design of PDZ Ligands as Inhibitors of 5-HT2A Receptor/PSD-95 PDZ1 Domain Interaction Possessing Anti-hyperalgesic Activity." ACS Chemical Biology 2013, 8(10), 2209-2216.
Financements
SATT Grand Centre / Clermont Auvergne Innovation (2018-2022)« Nouveaux traitements contre les douleurs neuropathiques »
Conseil Régional AuRA – Pack Ambition Recherche (2020-2024) « OPTI-PDZ »
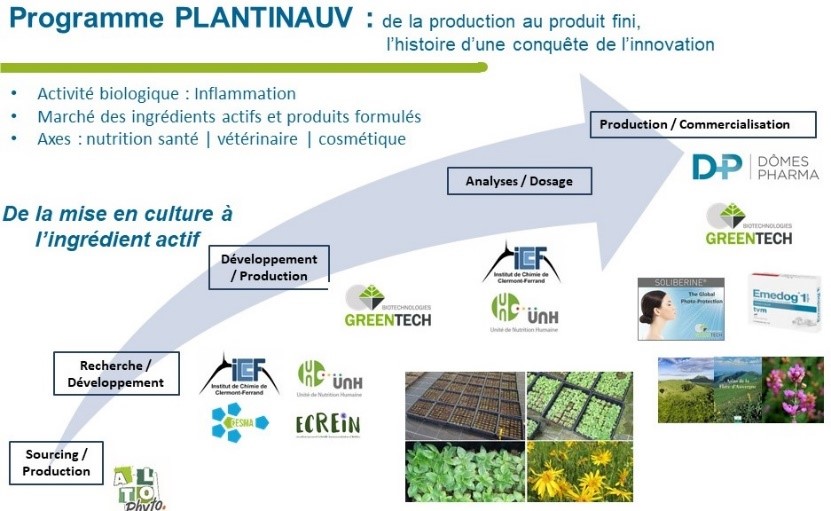
Programme PLANTINAUV: Développer une filière d'excellence de plantes médicinales du territoire Auvergne, de la culture à la valorisation d'ingrédients et de produits formulés
Le projet PLANTINAUV a pour objectif d’étudier des plantes médicinales issues de la flore d’Auvergne, reconnue pour sa richesse et sa diversité, qui, à l’heure actuelle, n’ont encore été que très peu investiguées. Relativement sous-exploité, le potentiel d'innovation lié aux activités biologiques de métabolites secondaires est pourtant considérable. En effet, le règne végétal constitue une source majeure de bioactifs qui sont à l'origine de plus de 50% des médicaments ayant obtenu une autorisation de mise sur le marché entre 1980 et 2010. Grâce aux complémentarités des compétences régionales, académiques et industrielle s, dans ce domaine d'activité, ce projet collaboratif a pour finalité l'étude et la valorisation de plantes auvergnates dotées d'activité anti-inflammatoire. À terme, le projet PLANTINAUV permettra le développement industriel de produits innovants pour des applications nutraceutiques, cosmétiques et vétérinaires. Ces plantes issues d'un sourcing et d'une production locale, garantiront une qualité maitrisée grâce à la mise en place d’une nouvelle filière de culture et d’approvisionnement régionale.
PLANTINAUV est un projet collaboratif rassemblant un consortium de 5 partenaires dont 3 entreprises (GREENTECH, DOMES PHARMA, AltoPhyto) membre de la chaire industrielle de Valorisation d’Ingrédients Végétaux bioActifs (VIVA) créée par SIGMA Clermont , et deux laboratoires de recherche (Unité de Nutrition Humaine – équipe ECREIN et Institut de Chimie de Clermont-Ferrand – équipe COM) des établissements d’enseignement supérieur (Université Clermont Auvergne, SIGMA Clermont). Il s’inscrit parfaitement dans le challenge 3 du programme I-Site CAP2025 : « La mobilité personnalisée comme facteur-clé de la santé » et bénéficie du soutient du pôle de compétitivité Végépolys Valley.
PUBLICATIONS ASSOCIEES
J. Cholet, C. Decombat, L. Delort, M. Gainche, A. Berry, C. Ogeron, I. Ripoche, M. Vareille-Delabre, M. Vermerie, D. Fraisse, C. Felgines, A. Rossary, E. Ranouille, J.-Y. Berthon, A. Tourrette, J. Priam, E. Saunier, Y. Troin, F. Senejoux, P. Chalard, F. Caldefie-Chezet, Potential Anti-Inflammatory and Chondroprotective Effect of Luzula sylvatica,Int. J. Mol. Sci, 2022, 24, 127.
J. Cholet, C. Decombat, M. Vareille-Delabre, M. Gainche, A. Berry, C. Ogeron, I. Ripoche, L; Delort, M. Vermerie, D. Fraisse, C. Felgines, E. Ranouille, J.-Y. Berthon, A. Tourrette, Y. Troin, F. Senejoux, P. Chalard, F. Caldefie-Chezet, Anti-inflammatory and antioxidant activity of an extract of Luzula sylvatica in a co-culture model of fibroblasts and macrophages, Curr Res Cmpl Alt Med, 2022, 6, 152.
M. Gainche, C. Ogeron, I. Ripoche, F. Senejoux, J. Cholet, C. Decombat, L. Delort, J.-Y. Berthon, E. Saunier, F. Caldefie Chezet, P. Chalard; Xanthine oxidase inhibitors from Filipendula ulmaria (L.) Maxim. and their efficient detections by HPTLC and HPLC analyses. Molecules, 2021, 26, 1939.
M. Gainche, I. Ripoche, F. Senejoux, J. Cholet, C. Ogeron, C. Decombat, O. Danton, L. Delort, M.Vareille-Delabre, A. Berry, A. M. Vermerie, D. Fraisse, C. Felgines, E. Ranouille, E. J.-Y. Berthon, J. Priam, E. Saunier, E. A. Tourrette, A. Y. Troin, F. Caldefie-Chezet, P. Chalard, Anti-inflammatory and cytotoxic potential of new phenanthrenoids from Luzula sylvatica, Molecules, 2020, 25 (10), 2372.
J. Cholet, C. Decombat, M. Vareille-Delarbre, M. Gainche, A. Berry, F. Sénejoux, I. Ripoche, L. Delort, M. Vermerie, D. Fraisse, C. Felgines, E. Ranouille, J.-Y. Berthon, J. Priam, E. Saunier, A. Tourette, Y. Troin, P. G. Thebaud, P. Chalard, F. Caldefie-Chezet, In Vitro Anti-Inflammatory and Immunomodulatory Activities of an Extract from the Roots of Bupleurum rotundifolium, Medicines, 2019, 6 (4), 101
J. Cholet, C. Decombat, M. Vareille-Delabre, M. Gainche, A. Berry, C. Ogeron, I. Ripoche, L. Delort, M. Vermerie, D. Fraisse, C. Felgines, E. Ranouille, J.-Y. Berthon, A. Tourrette, Y. Troin, F. Senejoux, P. Chalard, F. Caldefie-Chezet, Comparison of the anti-inflammatory and immunomodulatory mechanisms of two medicinal herbs : meadowsweet (Filipendula ulmaria) and harpagophytum (Harpagophytum procumbens), IJPAES, 2019, 9 (3), 145-163.

Projet NemaBod: Synthèse de sondes fluorescentes et suivi de molécules actives par microscopie de fluorescence dans le nématodes C. Elegans
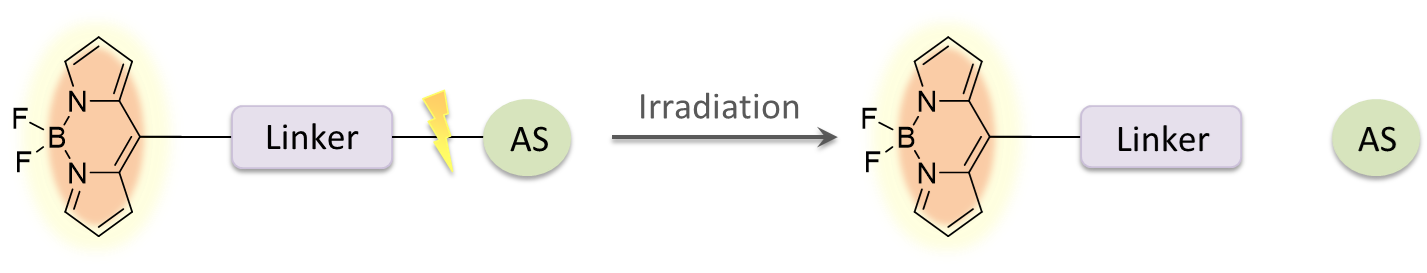
L’objectif de ce projet est de mettre au point une technique de marquage fluorescent permettant de suivre en microscopie à fluorescence le devenir d’une molécule ou d’un microorganisme in vivo, dans l’intestin du nématode Caenorhabditis elegans. Cette approche permettra de vérifier l’ingestion de la molécule et/ou du microorganisme et d’étudier son impact in vivo. Pour cela, une sonde fluorescente sera chimiquement synthétisée. Elle sera ensuite couplée à une molécule d’intérêt (anti-inflammatoire, anti-oxydante, anti-pathogène...) elle-même pouvant être attachée à la surface d’une bactérie ou internalisée dans un microorganisme à potentiel bénéfique chez l’hôte (activité probiotique, intérêt nutritionnel). Nous pourrons ainsi suivre la fluorescence grâce à la transparence du nématode, et étudier le devenir et l’impact de ces microorganismes et molécules marqués in vivo. Une seconde génération de sonde est actuellement en préparation. Celle-ci intègre un lien photoclivable. Une fois dans le nématode, il sera alors possible de libérer un principe actif par irradiation afin d’évaluer l’effet de dernier.
FINANCEMENT
Bourse de thèse MESRI
Projet VDA
Description du projet
L’histoire commence en 1995 avec l’isolement d’un principe actif bioactif d’une plante chinoise utilisée dans le traitement du cancer. La synthèse d’analogues de type « chalcone » a permis de comprendre leur mode d’action en tant qu’inhibiteurs de la tubuline. La protéine tubuline est une cible thérapeutique importante, sa polymérisation en microtubules est vitale à la cellule pour sa division (mitose), ses déplacements et son architecture. La perturbation de cette protéine structurelle provoque un changement à la forme des cellules endothéliales responsables, entre autres, de la vascularisation tumorale et de maladies ophtalmologiques. Les molécules perturbant la vascularisation (ou VDA, Vascular disrupting agent) ciblent ainsi l’angiogenèse et possèdent un fort potentiel pour le traitement de différentes pathologies (cancer, endométriose, DMLA, arthrose). Ce projet vise à développer des molécules à activité duale contre l’arthrose : prévention de l'angiogenèse ostéochondrose et douleur (analgésie) 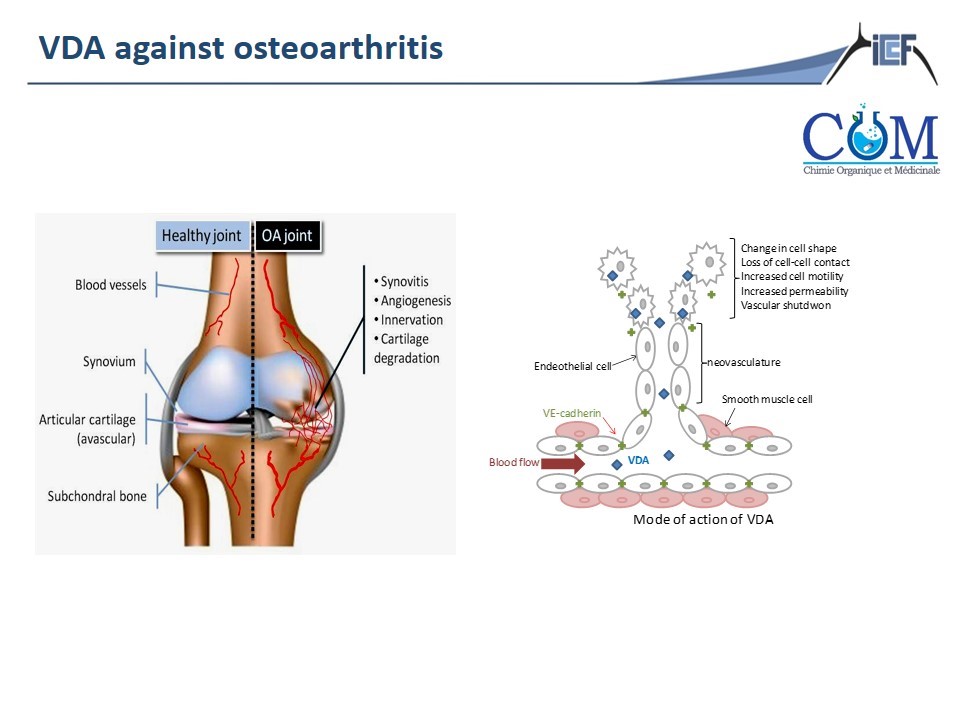
Publications associées
Ducki, S., Mackenzie, G., Lawrence, N.J., Snyder, J.P. “Quantitative structure-activity relationship (5D-QSAR) study of combretastatin-like analogues as inhibitors of tubulin assembly” Journal of Medicinal Chemistry 2005, 48 (2) , 457-465.
Lawrence, N.J., Patterson, R.P., Ooi, L.-L., Cook, D., Ducki, S. “Effects of α-substitutions on structure and biological activity of anticancer chalcones” Bioorganic and Medicinal Chemistry Letters, 2006, 16, 5844-5848.
Lawrence, N.J., Armitage, E.S.M., Greedy, B., Cook, D., Ducki, S., McGown, A.T. “The synthesis of indanones related to combretastatin A-4 via microwave-assisted Nazarov cyclization of chalcones” Tetrahedron Letters, 2006, 47, 1637-1640.
Sylvie Ducki, Grant Mackenzie, Ben Greedy, Simon Armitage, Jérémie Fournier-Dit-Chabert, Elizabeth Bennett, Jim Nettles, James P. Snyder, Nicholas J. Lawrence “Combretastatin-like chalcones as inhibitors of microtubule polymerisation. Part 2: Structure-based discovery of alpha-aryl chalcones” Bioorganic & Medicinal Chemistry, 2009, 17(22), 7711-7722.
F. Aribi, C. Vey, D. Topkaya, S. T. Kostakoglu, J. Fournier-dit-chabert, S. Buyukeksi, G. C. Taskin, S. Alpugan, F. Albrieux, A. G. Gurek, M. Cucca,Kk. Bennis, D. Atilla, V. Ahsen, S. Ducki, F. Dumoulin “Phthalocyanine-chalcone conjugates” Journal of Porphyrins and Phthalocyanines, 2016, 20, 497-504.
Financements
Conseil Régional - Bourse Innovation (2011-2012) « Commercialisation d’agents anticancéreux capable de détruire sélectivement la vascularisation tumorale »
PHC Bosphore (2012-2015) « Chalcone-conjugated phthalocyanines: Third generation photosensitisers targeting cancer neovasculature »
Laboratoires SERVIER (2015-2017) « Conception Synthèse et évaluation in vitro de nouveaux agents perturbateurs vasculaires pour le traitement de l’arthrose »
ANR OA-ANGIO-ANALGESIA (2016-2021) « L'Angiogénèse, Une Nouvelle Cible Thérapeutique contre l'Arthrose et les Douleurs Arthrosiques »
ISITE CAP 2025 Challenge 3 (2018-2021) « L'Angiogénèse ostéochondrale, Une Nouvelle Cible Thérapeutique contre l'Arthrose et les Douleurs Arthrosiques »
Criblage de molécules modulant l’activité transcriptionnelle de récepteurs nucléaires applicables au cancer de la prostate métastasé
DESCRIPTION
L’incidence du cancer de la prostate (CaP) est en constante augmentation dans les pays industrialisés. Parmi les acteurs moléculaires qui contrôlent l’homéostasie prostatique, les récepteurs nucléaires des oxystérols (LXRs) et celui des androgènes (AR) ont une place privilégiée. Les LXRs protègent du développement du CaP ; à l’inverse, les androgènes favorisent le développement du CaP via AR. Depuis quelques années, les stratégies thérapeutiques visent à réduire les sur-traitements des patients ayant un CaP métastasé. En effet, ces traitements offrent un bénéfice faible sur la survie, tout en ayant de forts aspects négatifs sur la qualité de vie. Deux familles de molécules qui ont été identifiés dans des travaux précédents présentent des perspectives prometteuses.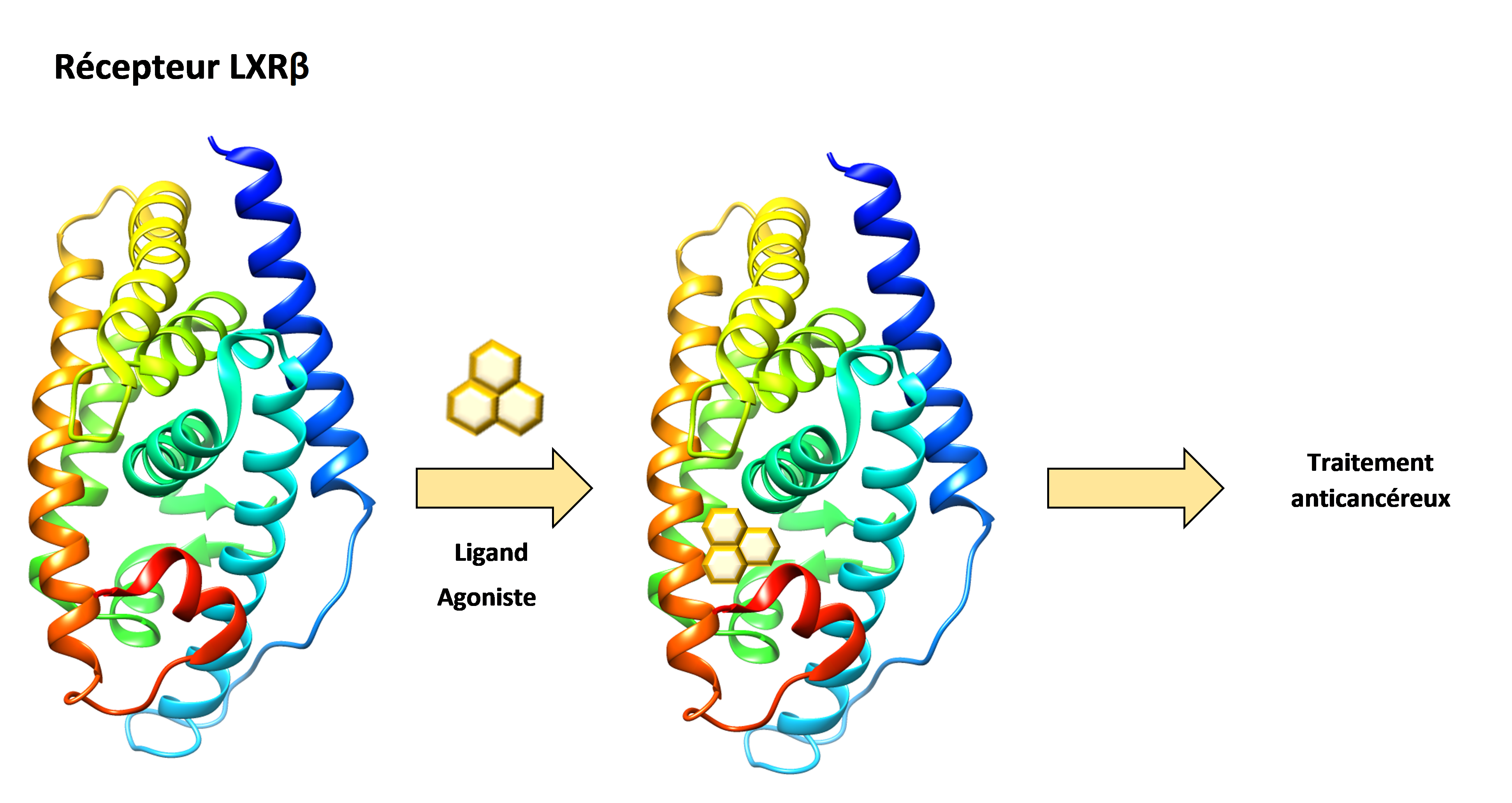
Ce projet est donc centré sur la synthèse et le criblage de familles molécules modulant l’activité de récepteurs nucléaires impliqués dans la physiologie prostatique, ceux des oxystérols LXRs et des androgènes AR. Le cancer de la prostate métastasé nécessite en effet de nouvelles stratégies thérapeutiques permettant d’activer les LXRs ou d’inhiber fortement AR tout en entraînant sa dégradation protéique. A partir de données préliminaires, les deux équipes proposent de développer une approche scientifique associant l’étude des interactions de molécules naturelles aux récepteurs LXRs ou AR afin de préciser les squelettes chimiques impliqués dans la réponse ; modifier ces molécules pour en renforcer l’activité et de les tester en culture de cellules. Les squelettes de molécules identifiées qui seront synthétisées (synthèse totale ou hémi synthèse) pourront provenir d’extraits de matrices naturelles. Celles-ci seront alors testées dans les modèles de cancer de prostate métastasé par nos collaborateurs biologistes de l’équipe du Pr. LOBACCARO.
FINANCEMENT
Emergence 2020 + Ligue pour le cancer (thèse 2022-2025)
Extraction et synthèse de molécules originales agonistes partielles ou antagonistes du récepteur au TRPA1 : implication dans la douleur de type migraineuse.
DESCRIPTION
La migraine, qui a une prévalence estimée à près de 15% de la population adulte, avec une prépondérance féminine, est classée parmi les six maladies les plus invalidantes par l’OMS. L’impact économique considérable de cette pathologie est évalué à environ 18 milliards d’euros par an pour la seule communauté européenne. Les crises de migraine sont caractérisées par des céphalées d’intensité modérée ou sévère, unilatérales, pulsatiles, pouvant durer entre 4 et 72 heures en l’absence de traitement. Pour traiter les épisodes migraineux, les patients ont à leur disposition un traitement « de crise » qui, pris dès l’apparition des symptômes, a pour objectif de diminuer la douleur et de réduire la durée de la crise ; et le traitement de fond, qui pris en continu, vise à réduire la fréquence des crises en rendant les migraineux moins sensibles aux facteurs déclenchants. Dans cette dernière catégorie, les traitements disponibles sont non spécifiques (bêtabloquants, antiépileptiques) et entrainent des effets secondaires. Même si ces dernières années, une nouvelle classe thérapeutique, les anticorps anti-CGRP, a montré une efficacité en termes de réduction du nombre mensuel de jours de céphalée migraineuse, ce traitement a deux inconvénients majeurs : son coût élevé (environ 10 000€ par patient/an) et son administration par voie sous-cutanée.
Depuis des milliers d’années, les médecines traditionnelles chinoise et indienne utilisent cette plante pour traiter les céphalées des patients. Récemment, il a été montré que le parthénolide, principe actif majeur de cette plante, interagit avec les récepteurs TRPA1 (Transient Receptor Potential Ankyrin1) qui sont présents sur les fibres nerveuses innervant les méninges (point d’origine de la douleur ressentie lors des céphalées ou migraines). De plus, dans une étude comparative, in vivo, réalisée par Neuro-Dol, il a été démontré que seuls les extraits contenant du parthénolide s’étaient montrés efficaces.

FINANCEMENT
Projet Bodox : Elaboration de nouvelles méthodes de criblage d’activité biologique par HPLTC via la mise au point de sondes fluorescentes originales
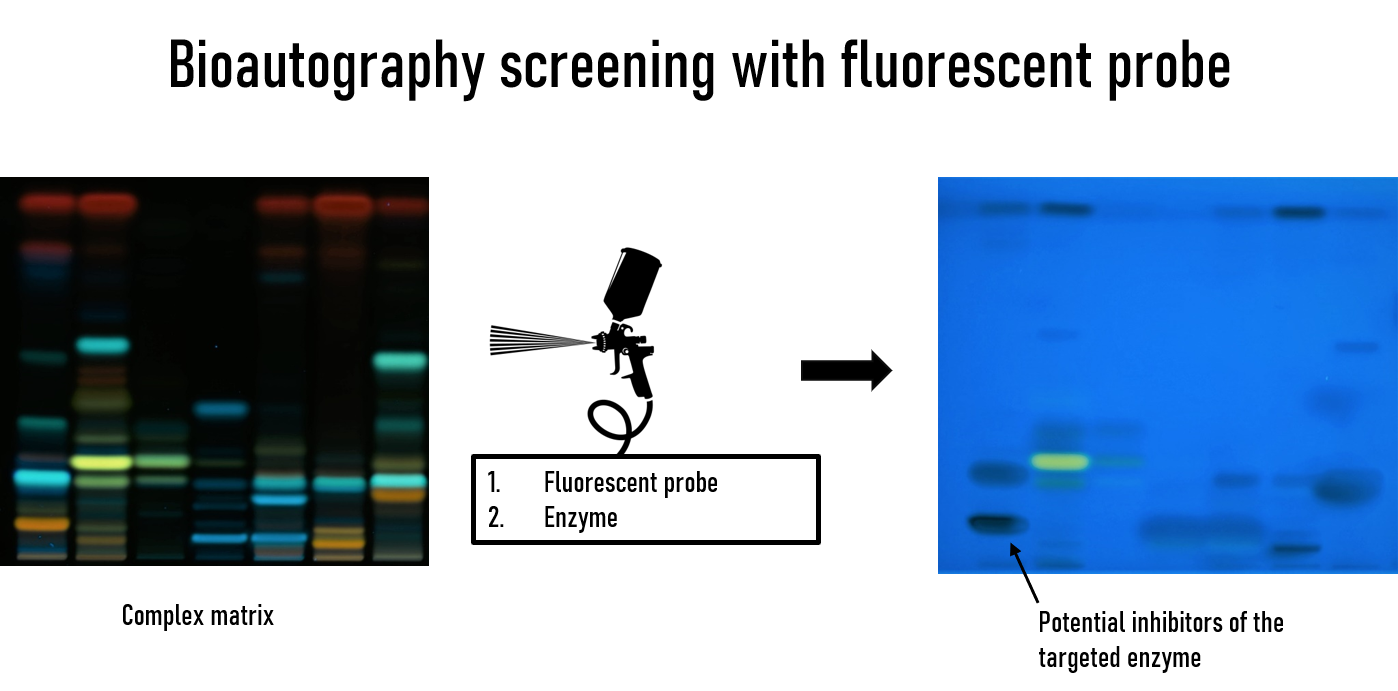
La bioautographie est une méthode permettant la séparation et l’identification facile de composés d’intérêt à partir de matrices complexe sur une plaque de chromatographie. Après leur séparation sur la plaque, les composés peuvent être évalués pour leur pouvoir d’inhibition sur l’activité enzymatique. Ainsi, à partir d’extraits végétaux complexes, plusieurs criblages, à partir d’enzymes cibles différentes, peuvent être réalisés simplement et en un temps restreint.
Le projet Bodox a pour but d’élaborer de nouvelles sondes fluorescentes pour une optimisation des essais d’activité biologique. L’approche proposé par l’équipe est versatile et permet la détection de l’activité d’un grand nombre d’enzyme en HPTLC. Pour cela, des sondes clivables, fonctionnalisées judicieusement sont synthétisées et ensuite comparées aux méthodes existantes ou pour la mise au point de nouvelles méthodes impliquant des enzymes non appliquées à ce jour en bioautographie HPTLC.
Les fromages comme source de métabolites bioactifs Innovants bénéfiques pour la santé (humaine et animale) en favorisant la mobilité
DESCRIPTION
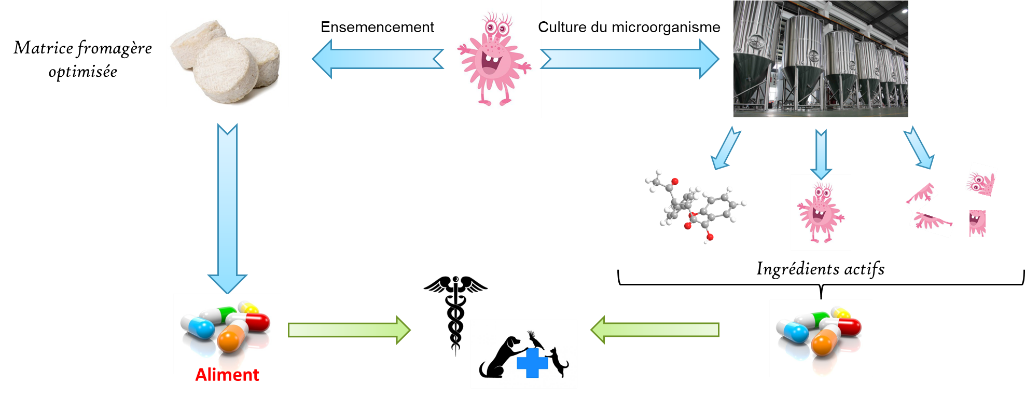
La nature constitue un réservoir de molécules d’une grande diversité. Les métabolites bioactifs naturels sont principalement issus des végétaux et à l’origine de plus de 50% des médicaments mis sur le Marché. La biodiversité microbienne a été peu explorée pour ses potentialités pharmacologiques (moins de 1%). La recherche de métabolites microbiens bioactifs devient essentielle pour l’innovation dans le secteur de la santé afin de développer de nouveaux médicaments et/ou compléments alimentaires. Pour exemple, les fromages (matrices alimentaires pouvant être considérées comme des bioréacteurs permettant la production de métabolites par des communautés microbiennes) n’ont jamais été étudiés en tant que réservoir de molécules et de microorganismes dotés d’activités bénéfiques pour la santé.
Les pathologies liées à l’allongement de la durée de vie impliquant des processus oxydatif et inflammatoire, notamment larthrose, sont de plus en plus fréquentes à la fois chez les humains et les animaux de compagnie. S’agissant d’un véritable problème de santé publique, les enjeux sociaux
et économiques de l’arthrose sont donc importants.
Depuis deux ans, un travail de thèse a permis de développer une méthode d’extraction et de fractionnement de molécules issues de fromages de chèvre et de mettre en évidence des activités biologiques pour plusieurs de ces fractions. Ces premiers travaux constituent la base du projet collaboratif FRIMOB, impliquant 3 établissements d’enseignement supérieur et de recherche (VetAgro Sup, Université Clermont Auvergne, SIGMA Clermont) et 2 partenaires socio-économiques
(Dômes Pharma et l’IRP).
Il a pour objectif d’étudier les fromages à microbiotes complexes (au lait cru) pour identifier i) des
métabolites secondaires actifs contre les troubles de la mobilité dont l’arthrose (recherche de métabolites aux propriétés anti-oxydantes, anti-inflammatoires et ayant une action sur la protection
du cartilage osseux), et ii) les microorganismes qui les produisent.
L’approche de FRIMOB est originale et innovante car ce projet associe deux expertises différentes mais complémentaires (la chimie et la biologie) pour étudier le fromage, non pas comme une simple matrice alimentaire, mais comme une potentielle matière première dotée d’activités biologiques. La finalité du projet permettra l’obtention de nouveaux ingrédients d’origine naturelle, à partir d’une matrice alimentaire, pour une utilisation en tant que produits microbiotiques en santé humaine et animale.
FINANCEMENTS
FRI Cluster 2019-2022 FROMACTIV
Pack Ambition Recherche 2020 FRIMOB
PUBLICATIONS ASSOCIEES
G. CARDIN, I. RIPOCHE, C. POUPET, M. BONNET, P. VEISSEIRE, P. CHALARD, A. CHAUDER, E. SAUNIER, J. PRIAM, S. BORNES, L. RIOS, “Development of an innovative methodology combining chemical fractionation and in vivo analysis to investigate the biological properties of cheese”, PLoS One, 2020, 15, e0242370
Études phytochimiques et activités biologiques d’extraits de plantes médicinales utilisées en médecine traditionnelle dans des pays d’Afrique
DESCRPTIONDepuis toujours, l’Homme a su utiliser son environnement, et plus particulièrement les plantes, pour se nourrir et se soigner. L’utilisation de plantes à des fins nutritives ou médicinales est probablement l’une des sciences les plus documentées de l’histoire ancienne.
Avec l’essor de la chimie moderne au XIXème puis au XXème siècle, les scientifiques se sont rendu compte du formidable réservoir thérapeutique que recelait les plantes, les champignons et les micro-organismes. On peut entre autres citer la découverte d’anticancéreux très efficaces, extraits de Catharenthus roseus (la pervenche de Madagascar), la vinblastine et la vincristine (1954).

Afin d’explorer le fort potentiel offert par cet axe de recherche des enseignants chercheurs de Sigma Clermont (équipe Chimie Organique et Médicinale, ICCF UMR 6296), de la Faculté de Pharmacie de Clermont-Ferrand, (équipe ECREIN, UNH UMR ) en collaboration avec les chimistes de l’Université Mairen Ngouabi (Congo Brazzaville), ont réuni leurs efforts depuis plus de 10 ans pour explorer les activités biologiques (notamment antitumorales, antalgiques et anti-inflammatoires) de plantes médicinales utilisées par les tradithérapeutes du Congo Brazzaville.
Cet axe de recherche au fort potentiel scientifique nous a également permis de collaborer avec d’autre pays d’Afrique tels que l’Algérie, le Mali le Cameroun et le Maroc.
FINANCEMENTS
SCAC Ambassade de France Congo Brazzaville (allocations doctorales 2019-2026)
SCAC Ambassade de France au Mali (allocation doctorale 2014-2019)
Agence Française de Développement – Programme d’appui à la modernisation de l’enseignement supérieur (AMES)
Programme Franco-Marocain Toubkal
PUBLICATIONS ASSOCIEES
G. BOUNGOU-TSONA, M. GAINCHE, C. DECOMBAT, I. RIPOCHE*, K. BIKINDOU, L. DELORT, F. CALDEFIE-CHEZET, A. LOUMOUAMOU, P. CHALARD*, Chemical Profile, Antioxidant and Anti-Inflammatory Potency of Extracts of Vitex madiensis Oliv. and Crossopteryx febrifuga (Afzel ex G. Don), Plants, 2023, 13, 386.
E-M. OURHZIF, A. RICELLI, V. STAGNI, A. CIRIGLIANO, T. RINALDI, L. BOUISSANE, L. SASO, P. CHALARD, Y. TROIN, M. KHOUIL, M. AKSSIRA, Antifungal and cytotoxic activity of diterpenes and bisnorsesquiterpenoides from the Latex of Euphorbia resinifera Berg., Molecules, 2022, 27, 5234.
E.M. OURHZIF, I. ABRUNHOSA THOMAS, P. CHALARD, M. KHOUILI, Y. TROIN, M. AKSSIRA, E.M. KETANI, Synthesis, Characterization, Crystal Structure, Hirshfeld surface analysis and DFT studies of novel compounds based on the methoxynaphthalene ring, Journal of Molecular Structure, 2021,130945
E.M. OURHZIF, C. DECOMBAT, I. ABRUNHOSA THOMAS, L. DELORT, M. KHOUILI, M. AKSSIRA, F. CALDEFIE CHEZET, P. CHALARD, Y. TROIN, Synthesis and biological evaluation of new naphthoquinones derivatives, Current Organic Synthesis, 2020, 17, 224
E.M. OURHZIF, A. PARIS, I. ABRUNHOSA THOMAS, E.M. KETANI, P. CHALARD, M. KHOUILI, R. DANIELLOU, Y. TROIN, M. AKSSIRA, Design, synthesis and evaluation of cytotoxic activities of arylnaphthalene lignans and aza-analogs, Arch. Pharm., 2021, e2000479